معرفی
مزیت فیزیولوژیک حضور هموگلوبین در گلبول قرمز، بهبود در رساندن اکسیژن به بافتها و اعضای بدن است. قابلیت حل اکسیژن در آب بسیار پایین است، بنابراین مقادیر کمی اکسیژن از طریق diffusion منتقل میشود. هموگلوبین، امکان انتقال اکسیژن از یک راهِ سریعتر و کارآمدتری را نسبت به diffusion، فراهم میآورد. وجود هموگلوبین، میزان اکسیژن قابل انتقال در یک لیتر خون را تا ۵۰ برابر افزایش میدهد. هموگلوبین (Hb) یک پروتئین است که در گلبولهای قرمز یافت میشود و نقشی اساسی در حمل اکسیژن (O2) و دیاکسیدکربن (CO2) ایفا میکند.
فهرست
عملکرد هموگلوبین
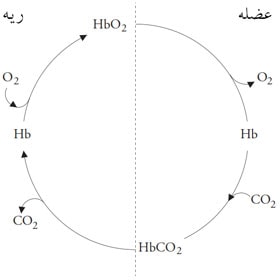
هموگلوبین اکسیژن را از ریه دریافت میکند تا اُکسیهموگلوبین (Oxyhemoglobin) را شکل دهد و آن را به بافتها و اعضای بدن برساند، جاییکه اکسیژن را آزاد نموده و دیاکسیدکربن را جذب میکند. به ترکیب دیاکسیدکربن و هموگلوبین، کربامینوهموگلوبین (Carbaminohemoglobin) گفته میشود و CO2 را به ریهها حمل میکند (مطابق شکل ۱)
هموگلوبین همچنین یک فعالیت بافرینگ هم انجام میدهد؛ به دلیل اینکه میتواند با یونهای هیدروژن ترکیب شود، در نگهداشتن pH خون در یک مقدار ثابت، یک نقش اساسی ایفا میکند.
غلظت کل هموگلوبین (Total Hemoglobin concentration) یک معیار از کمیت این پروتئین بر حجم خون است و در واحد گرم بر ۱۰۰ میلیلیتر (g/dl) از خون وریدی گزارش میشود. در یک انسان بالغ نرمال، مقادیر میانگین 15g/dl برای آقایان و 13g/dl برای خانمها است. در هنگام تولد، غلظت میانگین هموگلوبین حدود 20g/dl است اما به سرعت به مقدار 12g/dl کاهش پیدا میکند و تا سنین ۱۰-۱۲ سال ثابت باقی میماند، سپس به آرامی به مقادیر فرد بالغ افزایش پیدا میکند.
ساختار هموگلوبین
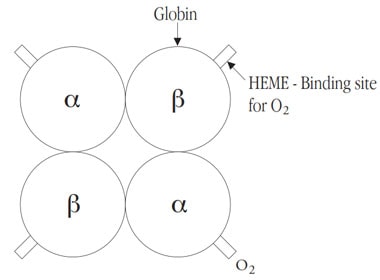
هموگلوبین یک پروتئین با وزن مولکولی 67٬000 است و شکل عملکردی (functional form) آن یک ساختار تترامریک (tetrameric structure) دارد. این ساختار نتیجهی ترکیب چهار زیر-واحد (sub-unit) به نام گلوبین (globin) بوده و نشاندهندهی تعامل داینامیک بین آنها است. هر زیرواحد یک مولکول ارگانیک حلقه-گونه (ring-shaped) به نام heme دارد که حاوی یک اتم آهن است؛ heme گروهی است که در ترکیب قابلبازگشت (reversible binding) اکسیژن توسط هموگلوبین میانجیگری میکند.
مکانیزم ترکیب هموگلوبین با اکسیژن
ترکیب اولین مولکول اکسیژن (O2) با یک زیرواحد مولکول هموگلوبین، ترکیب سایر مولکولهای اکسیژن با زیرواحدهای آزاد (free subunits) را بسیار تسهیل میکند. این نوع ترکیب، که به آن cooperative گفته میشود، بر اساس تعامل داینامیک بین زیرواحدها است که با تغییرات ساختاریِ ایجاد شده توسط ترکیب اکسیژن با اولین زیرواحد، در سراسر مولکولِ هموگلوبین به سایر زیرواحدها انتقال مییابد. این تغییر ساختاری (Conformational Change) که در مکانی با فاصله از مکان ترکیب، القا میشود، اثر آلوستریک (allosteric effect) نامیده میشود (شکل ۳ را ببینید). این اثر در مقایسه با زمانی که زیرواحدها مجزا باشند، باعث افزایش دو برابری مقدار اکسیژن حمل و رها شده توسط هموگلوبین میشود.
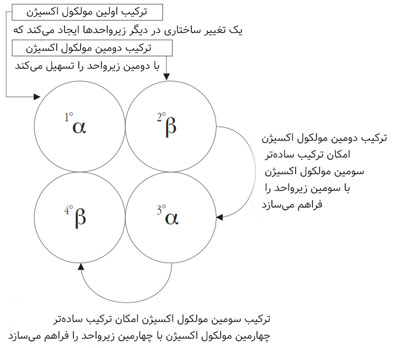
مکانیزم مولکولی این اثر که بر اساس دگرگونی ساختاری (structral alteration) است، و به آن تغییر ساختاری (Conformational Change) هم گفته میشود، سطح تماس بین زیرواحدها را بهبود میبخشد و میل ترکیبی (affinity) آنها (یعنی ظرفیت ترکیب (binding capacity) آنها) به اکسیژن را افزایش میدهد.
میل ترکیبی به اکسیژن همچنین بهوسیلهی مولکولهای خاصی که میتوانند ظرفیت ترکیب با اکسیژن را (بهوسیلهی تعامل با مکانهایی از هموگلوبین به غیر از heme) بهبود بخشند، تنظیم میشود.
تنظیم عملکردهای هموگلوبین
هموگلوبین میتواند O2 و CO2 را حمل و منتقل کند و فعالیت ترکیبی آن را میتوان بهوسیلهی مولکولهای تنظیمی (regulatory molecules) تعدیل کرد که علاوه بر اکسیژن و دیاکسیدکربن، یونهای هیدروژن (یا یونهای +H) و ۲، ۳ diphosphoglycerate (یا DPG) را هم شامل میشود. بسیار مهم است که تاکید کنیم که تمام ویژگیهای عملکردی مولکول هموگلوبین به شدت به ساختار تترامتریک آن وابسته است. در واقع، زنجیرههای مستقل گلوبین اثر آلوستریک را از خود نشان نمیدهند؛ برای مثال زنجیرهی آلفا میل ترکیبی زیادی به O2 دارد که تغییرات pH (که غلظت یونهای +H است)، دیاکسیدکربن و غلظت DPG، روی آن تاثیر نمیگذارد.
میل ترکیبی هموگلوبین با اکسیژن به pH و CO2 و غلظت DPG بستگی دارد که به شرح زیر است:
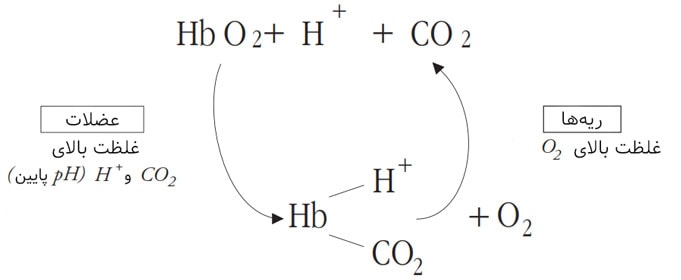
مقادیر کم pH (همان افزایش غلظت یون +H) و سطح بالای CO2، هموگلوبین را وادار به رهاسازی اکسیژن میکند.
افزایش غلظت O2 در ریهها هموگلوبین را وادار به رهاسازی یونهای +H و دیاکسیدکربن میکند.
به تعادل بین O2، یونهای +H و دیاکسیدکربن اثر Bohr گفته میشود (شکل ۴)
تنها مقدار کوچکی از کل دیاکسیدکربن تولیدشده در طول متابولیسم هوازی (aerobic metabolism)، توسط هموگلوبین منتقل میشود، به دلیل اینکه ترکیب CO2 باعث کاهش میل ترکیبی هموگلوبین با اکسیژن میشود. اکثر CO2 درون گلبول قرمز توسط یک آنزیم به نام کربنیک انیدراز (Carbonic hanydrase)، تبدیل به بیکربنات (-HCO3) میشود.
مولکول دیگری که یک نقش مهم تنظیمکنندگی برای ترکیب اکسیژن ایفا میکند (disphosphoglycerate 2-3 (DPG است. این مولکول ارگانیک، که با غلظتی نزدیک به غلظت هموگلوبین درون گلبول قرمز وجود دارد، یک نقش فیزیولوژیکی مرتبط در جهت کاهش میل به ترکیب هموگلوبین با اکسیژن ایفا میکند. در واقع، عدم حضور DPG، میزان اکسیژن رها شده برای بافتها توسط هموگلوبین را به طور چشمگیری کاهش میدهد.
هموگلوبین نرمال (طبیعی)
بخش پروتئینی مولکول هموگلوبین انسانی از دو جفت زنجیرهی پلیپپتیدی (Polypepetidic) به نام گلوبینها ساخته شده است. دو زنجیره از نوع آلفا (α) و دو زنجیره از نوع غیر-آلفا (non-α) که شامل زنجیرههای بتا (β)، گاما (γ) و دلتا (δ) میشود.
جدول ۱ انواع مختلف هموگلوبینهایی که در یک فرد بالغ نرمال پیدا میشود را نشان میدهد. حرف «A» معادل «Adult» (به معنی فرد بالغ) و «F» معادل «Fetal» (به معنی جنینی) هستند. هموگلوبین گلیکوزیله، نوعی دیگر از HbA که در گلبول قرمز یافت میشود، حاوی یک مولکول هگزوز (یک مولکول قندی) است که ترکیب عمومی زنجیرههای گلوبین آن α2ββ است.
| نوع هموگلوبین | ترکیب زنجیرهی گلوبین | درصد نسبت به غلطت کل هموگلوبین |
| HbA یا HbA1 | α2β2 | ۹۸ – ۹۵ ٪ |
| HbA2 | α2δ2 | ۳٬۵ – ۱٬۵ ٪ |
| HbF | α2γ2 | ۲ – ۰ ٪ |
جدول ۱ – انواع هموگلوبینهای انسانی در یک فرد بالغ نرمال
سنتز هموگلوبین
مولکول کاملِ در حال کار هموگلوبین از چهار زیرواحد تشکیل شده که ترکیب آنها یک تترامر (tetramer) ایجاد میکند؛ برای مثال ساختار α2β2 مربوط به HbA.
مکانیزم پیوستگی بین چهار زنجیرهی گلوبین شامل جفت شدن دو زنجیره از یک نوع مشابه است که یک دایمر (dimer) هموگلوبین تولید میکند. دو دایمر، یکی از زنجیرههای آلفا (α) و دیگری از زنجیرههای غیر-آلفا (non-α) که برای تشکیل انواع مختلف هموگلوبینها با هم ترکیب شدهاند. برای مثال، دایمر α2 با دایمر β2 ترکیب شده تا تترامر α2β2 مربوط به HbA1 را تشکیل دهند.
سنتز پروتئین با ژنهای ساختاری که حاوی اطلاعات برای توالی پلیپپتیدی (اسماً نوع و جایگاه اسید آمینهی آن پروتئین) هستند، تحت کنترل ژنتیکی است. برای هر نوع پروتئین دو آلل (alleles) وجود دارد که برای ساختار پروتئین کد میشوند و حاوی دستورالعملهایی برای کنترل نرخ تولید (یا سنتر) هستند. کنترل سنتز زنجیرههای پلیپپتیدی هموگلوبین خصوصیات ویژهای را به نمایش میگذارد:
- سنتز هر نوع از زنجیره، نتیجهی بازتاب ژن ساختاری مرتبط است، اما مولکول کامل هموگلوبین به پیوستگی چهار زنجیره وابسته است. بنابراین درحالیکه سنتز یک جز، تحت کنترل ژنتیکی قرار دارد، اجتماع زنجیرههای گلوبین از کنترل ژنتیکی مستقل است.
- در گلبول قرمز یک فرد بالغ نرمال، ۳ نوع هموگلوبین مختلف وجود دارد، HbA1 و HbA2 و HbF. که هر کدام از تترامرهای مختلفی تشکیل شدهاند (جدول ۱ را ببینید).
- علاوه بر این، تناسب نسبی این سه نوع هموگلوبین درون گلبول قرمز برابر نیست، به دلیل اینکه غلظت آنها تا حد زیادی متفاوت است (جدول ۱ را ببینید). درصدهای متفاوت هر نوع هموگلوبین تنها وابسته به نرخهای متفاوت سنتز زنجیرههای پلیپپتیدی است و نتیجهی میل به ترکیبهای متفاوت بین زنجیرههای گلوبین نیست. نرخ سنتز میتواند به وسیلهی یک ژن ریپرسور که مختص آن پروتئین است، اصلاح شود.
اصلاح قابل توجه تناسب بین HbA1 و HbF از جنینی تا بلوغ، یک مشخصهی منحصربهفرد سنتز هموگلوبین است.
سنتز هموگلوبین در طول رشد و نمو
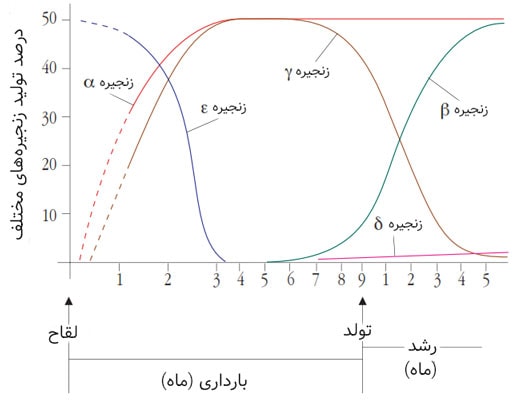
در طول رشد از جنینی تا بلوغ، ترکیب گلوبینهای ساختار مولکولی هموگلوبین دستخوش تغییرات بسیار زیادی میشود. انواع هموگلوبینهایی که در طول رشد یافت میشود در ادامه آمده است:
- در جنین (embryo)، تا دو ماه اول از زندگی رحمی بعد از لقاح، و در نوزاد (newborn)، هموگلوبین Hb Portland با ترکیب δ2γ2 یافت میشود.
- در جنین (fetus)، در طول هفتههای ۱۰ تا ۱۲ اول رشد، دو نوع هموگلوبین یافت میشود: Gower I (یا ε4) و Gower II (یا ε2α2).
- بعد از این دوره، سنتز هموگلوبین Gower متوقف شده و سنتز HbF شروع میشود؛ HbF (یا α2γ2) هموگلوبین اصلی، در جنین در حال رشد است.
- سنتز HbA1 (یا α2β2) بین هفتههای هجدم و بیستوچهارم بارداری آغاز میشود. همچنان مقدار HbF نسبت به HbA1 بیشتر است.
- مرحلهی تغییر تصاعدی از هموگلوبین جنینی به بالغ، که به آن «switch» هم گفته میشود، بعد از هفتهی سیودوم رخ میدهد.
این تغییرات در ساختار پروتئین هموگلوبین، بیان مدولهشدهی ژنهای مختلف را منعکس میکند؛ که موجب سنتز زنجیرههای مختلف گلوبین میشود (شکل ۵ را ببینید).
هموگلوبینوپاتیها و تالاسمی
این عبارت تعداد زیادی از اختلالهای ارثی را دربرمیگیرد که میتوانند تغییرات کیفی در ساختار هموگلوبین یا تغییرات کمی در سنتز هموگلوبین تولید کنند که در نهایت منجر به یک عدم تعادل در غلظت انواع مختلف هموگلوبینها میشود.
ژنهای جهشیافته میتوانند مغلوب (recessive) یا هم-بارز (co-dominant) باشند.
در شکل هموزیگوت، ژن به صورت کامل بیان میشود و اثرات پاتوفیزیولوژیکی شدیدی تولید میکند، مانند تالاسمی ماژور و آنمی کولی (Cooley’s anemia) که اغلب باعث سختتر شدن پیشبینی میشود.
هتروزیگوتهای مجزا برای هر ژن غیرطبیعی، حاملهای خاموش هستند، به دلیل اینکه این ژن پنهان میماند و هیچ اثر بالینی (Clinical) ایجاد نمیکند، یا اثرات خیلی کم بالینی (Sub-Clinical Presentation) مانند تالاسمی مینور ایجاد میکند.
اگرچه عبارت «هموگلوبینوپاتی» شبیه یک بیماری به نظر میرسد، تعداد کمی از آنها منجبر به بیماریهای جدی میشوند. اکثر آنها به صورت بالینی آشکار نیستند و الگوهای هماتولوژیکی غیرطبیعیِ بدون علامت ایجاد میکنند که تنها از طریق تحقیقات آزمایشگاهی قابل شناسایی هستند.
-
ناهنجاریهای کیفی هموگلوبین
برخی هموگلوبینهای غیرطبیعی، با توجه به تعویض یک یا چند اسید آمینه در زنجیره(ها)ی پلیپپتیدی، تغییراتی کیفی در ساختارشان به نمایش میگذارند؛ این هموگلوبینها را «غیرطبیعی» مینامند یا به صورت دقیقتر «variant hemoglobins». حدود ۴۰۰ هموگلوبین غیرطبیعی در انسان شناسایی شده است.
هموگلوبینهای طبیعی و غیرطبیعی حرکات الکتروفورتیک متفاوتی از خود نشان میدهند و میتوان با الکتروفورز منطقهای روی استات سلولز آنها رو شناسایی کرد.
حدود یک/چهارم این هموگلوبینهای غیرطبیعی را میتوان با روشهای تحلیلی کلاسیک مثل الکتروفورز با محلولهای قلیایی و اسیدی، شناسایی کرد. تحقیق و بررسی انواع دیگر هموگلوبین، اغلب نیاز به روشهای پیچیدهی آزمایشگاهی دارد.
هموگلوبینهای غیرطبیعی که اهمیت ویژهی بالینی دارد عبارتاند از:
HbS
این هموگلوبین یک دگرگونی در زنجیرهی بتا را دربردارد که شکل دیاکسیژنه (deoxy-HbS) را ناپایدار میکند و منجر به رسوب در محلول میشود. گلبولهای قرمزی که حاوی deoxy-HbS هستند مشخصههایی از جمله کشیدگی، نوکتیزی و کمی خمیدگی را شکل میدهند و «سلولهای داسی شکل – Sickle Cells» نامیده میشوند. تمایل گلبول قرمز به داسی شکل شدن (Sickle) با افزایش مقدار deoxy-HbS افزایش مییابد. بنابراین، افرادی که به خاطر ژن HbS، هتروزیگوتی هستند، حدود ۳۰ تا ۴۰ درصد HbS دارند و «سلول داسی شکل – Sickle Cells» تشکیل نمیدهند مگر اینکه شرایط فیزیولوژیکی خارقالعادهای رخ دهد؛ این شرایط، که به آن «sickle cell trait» نیز گفته میشود، نوعی محافظت در مقابل اثرات بالینی مالاریا، ناشی از Plasmodium Falciparum، ایجاد میکند. این موضوع میتواند دلیل بالا بودن میزان شیوع این ژن در مناطق گرمسیر آفریقا تا میزان ۴۰٪ باشد.
افرادی که هموزیگوت هستند، مثلا کسانی که HbS آنها ۱۰۰٪ است، متاسفانه تحت هر شرایطی «سلول داسی شکل – Sickle Cell» ایجاد میکنند؛ بیان هموزیگوت این ژن یک کمخونی (anemia) همولیتیک مزمن شدید ایجاد میکند که به آن «sickle cell disease» میگویند و در نهایت منجر به مرگ بیمار میشود.
HbC
این نوع هموگلوبین همچنین یک دگرگونی در زنجیره بتا دارد و به صورت گسترده اما با شیوع کم در میان افراد آفریقایی-آمریکایی شایع است. HbC trait بدون نشانه (asymptomatic) است در حالیکه هموزیگوتها علائم کمخونی مزمن و اسپلنومگالی (Splenomegalia) را به نمایش میگذارند که اثراتشان معمولاً خفیفتر از «sickle cell disease» است.
HbE
این نوع دگرگونی زنجیرهی بتای هموگلوبین در میان مردم جنوبشرق آسیا بسیار شایع است. هتروزیگوتها بدون نشانه (asymptomatic) با میکروسیتوز و بدون کمخونی (anemia) هستند. حالت هموزیگوت، یک میکروسیتوز شدیدتری در ارتباط با هیپوکرومیک (hypochromia) ایجاد میکند.
-
ناهنجاریهای کمی هموگلوبین
اختلالهای هموگلوبین ممکن است به صورت کمی نیز ظاهر شوند که ممکن است نتیجهی اختلال در تولید بوده که ناشی از موارد زیر باشند: کاهش یا توقف سنتز زنجیرهی گلوبین طبیعی، مانند تالاسمی؛ رخ دادن دگرگونی در طول رشد جنین، مانند ماندگاری ارثی هموگلوبین جنینی، که در این حالت ژن در نوزادی «خاموش» نشده و تا بلوغ ماندگار میشود.
تالاسمی
این عبارت به گروهی از بیماریها (که به آن سندرم هم میگویند) با اثرات بالینی مشابه اشاره دارد که خصیصهی پزشکی اصلی آنها ناتوانی در حفظ تعادل بین نرخ سنتز یک نوع زنجیرهی گلوبین و جفتش است. برای عملکرد طبیعی HbA برابر بودن تعداد زنجیرههای آلفا و بتا ضروریاند. کاهش سنتز یک نوع از زنجیرههای گلوبین باعث پیوند چهارتایی (tetramers) نوع دیگر زنجیرهی گلوبین میشود که معمولاً غیرفعال هستند. عدم تعادل گلوبینها به گلبولهای قرمز آسیب زده و آنها را از بین میبرد که منجر به کمخونی (anemia) میشود. کاهش نرخ سنتز بیشتر در زنجیرهی بتا مشاهده میگردد. اگر چه تالاسمی برای هر چهار زنجیرهی گلوبین (که در جدول ۱ لیست شدهاند) تشریح شده است، نوع بتا و آلفا به صورت مختصر مرور میشوند.
تالاسمی بتا
این نوع، شکل کلاسیک تالاسمی است اما شایعترین نیست. این نوع تالاسمی توسط کاهش یا توقف کامل سنتز زنجیرهی بتا به همراه افزایش زنجیرههای آلفا و دلتا، مشخص میشود. تالاسمی ماژور در هموزیگوتها برای ژن تالاسمی بتا یافت میشود. اثرات بالینی آن شامل کمخونی شدید میشود که اثر پاتوفیزیولوژیک آن سیروز (cirrhosis)، نارسایی پانکراس و قلبی ایجاد میکند. در این نوع تالاسمی HbA1 تقریباً وجود ندارد، HbF به میزان قابل توجهی افزایش یافته و غلظت HbA2 نیز کمی افزایش مییابد.
تالاسمی مینور بیان بالینی هتروزیگوتها برای هر ژن تالاسمی بتا است؛ اثرات کمینهی بالینی آن شامل کمخونی لبمرز (borderline anemia) و کاهش جزئی سنتز HbA1 شده، که موجب افزایش جزئی HbA2 و HbF میشود.
تالاسمی آلفا
تالاسمی آلفا که شایعترین نوع در میان هموگلوبینوپاتیها و تالاسمیها است، زمانی به وقوع میپیوندد که سنتز زنجیرهی آلفا کاهش پیدا کرده یا کاملاً متوقف میشود. برخلاف تالاسمی بتا، نوع آلفا حتی قبل از تولد نیز وجود دارد و گسترهی وسیعی از وضعیتهای بالینی را به نمایش میگذارد: هر دوی هتروزیگوتها و هموزیگوتها ممکن است بدون نشانه (asymptomatic) به همراه اختلالات ملایم آزمایشگاهی باشند؛ HbH disease حاصل یک ترکیب خاص از ژنهای معیوب برای زنجیرهی آلفا است و توسط حضور تترامرهای تشکیل شده از زنجیرهی بتا (β4) مشخص میشود. این نوع هموگلوبین، اکسیژن را بهصورت موثر حمل نمیکند و به پوستهی گلبول قرمز آسیب وارد میکند و در نهایت باعث تخریب سلول میشود. نوزادان مبتلا، از کمخونی همولیتیک از خفیف تا شدید رنج میبرند. تالاسمی آلفا – ۱ هموزیگوت اجازه به تولید زنجیرهی آلفا نمیدهد. این حالت با زندگی سازگار نیست و اکثر جنینهای مبتلا در رحم یا چند ساعت پس از تولد میمیرند.
-
ماندگاری ارثی هموگلوبین جنینی – Hereditary presistence of fetal hemoglobin
در این حالت ژن زنجیرهی گاما در نوزادی «خاموش» نمیشود و تا بلوغ ماندگار میماند. HPFH در آفریقا شایع است چرا که وجود HbF در افراد بالغ باعث «رقیق شدن» HbS شده (که در هموزیگوتها ممکن است تا ۹۷٪ کل هموگلوبین را تشکیل دهد) و در نتیجه منجر به کاهش داسیشکل شدن گلبولهای قرمز میشود.

دیدگاه بگذارید